Korozyon,elektron ve iyon akışını gerektiren bir elektrokimyasal süreçtir.
Metal kaybı (korozyon) anotta meydana gelir.Katotta metal kaybı olmaz.(Katot korunmaktadır.)Elektrokimyasal korozyon, metal/elektrolit ara yüzeyinde elektron transferini gerektirir.Korozyon 4 kısımdan oluşan bir korozyon hücresinde meydana gelir.
– Anot
– Katot
– Elektrolit
– Metalik bağ
Anotta metalik iyonlar üretimi sayesinde oluşan elektronlar elektriksel yol üzerinden geçerek elektrolite daldırılmış katodik yüzeye geçerler.Elektrolitte bulunan pozitif yüklü iyonlarla reaksiyona girerek elektriksel dengeyi tekrar kurarlar.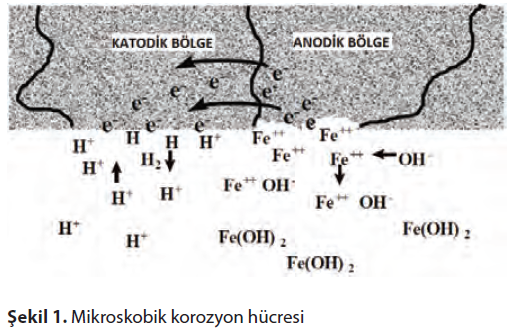
Şekil 1’de gösterildiği gibi, korozyon sürecini su içinde, aynı metalik yüzeyde bulunan bir anot ve bir katottan oluşan bir korozyon hücresinde inceleyelim. Aynı metal anot,katot ve elektriksel yolu (metalik bağ) içerir. Su ise korozyon hücresinin son bileşenini, yani elektroliti sağlar.
Elektrolit, küçük miktarlarda hidrojen (H+)ve hidroksil (OH–) iyonları bulunduracak şekilde iyonize olmuştur.
Metal iyonları,geride elektriksel yol üzerinden katodik yüzeye akacak elektronları bırakarak elektrolite girmek üzere anodik yüzeyden ayrılır.Katodik yüzeyde,anottan gelen elektronlar elektrolitteki hidrojen iyonları ile karşılaşır.Bir hidrojen iyonu bir elektron kabul eder ve hidrojen atomuna dönüşür.Hidrojen atomu diğer bir hidrojen atomuyla,ya katodik yüzeye yapışacak ya da daha sonra baloncuk olarak salınacak hidrojen gazı molekülü oluşturmak üzere birleşebilir.Bazı durumlarda hidrojen atomu, metal kafesine girerek hidrojen gevrekliği yaratabilir.
Bu arada,elektrolitte hidroksil iyonlarıyla birleşen metal iyonları, metal hidroksit (pas)oluşturarak metal yüzeyine çökelir.Bu süreç devam ettikçe,metal oksidasyonu (korozyon) anotta, hidrojen iyonu indirgenmesi ise katotta oluşur.
alıntı:
ELEKTROKİMYASAL KOROZYON İLKELERİ teknik makale Okan İŞDAŞ